¿Qué es una Proteína?
Es una macromolecula formada por una cadena de 50 o más Aa (véase Aminoácidos). Una proteína esta estructurada en cuatro niveles diferentes.
Estructura primaria:
Es la estructura unidimensional o secuencia lineal de Aa que constituyen la proteína unidos por enlaces peptídicos (vease Peptidos). Esta estructura primaria es importante ya que de ella derivan las propiedades físico-químicas. por ejemplo: el punto isoelectrico que se deberá a la mayor concentración de Aa básicos o ácidos.
Esta cadena es lineal por lo que no presenta ramificaciones, Esta cadena depende totalmente de la fuerza del enlace peptidico.
Estructura secundaria:
Es la estructura bidimencional de Aa sostenida por puentes de H (hidrógeno)
Un puente de H se establece entre restos del grupo NH2 (amina) de un enlace peptidico cuyo H es atraído por el O de restos CO (carbonilos) de otro enlace peptidico, de esta forma el H forma un puente entre dos átomos electronegativos.
Si bien un puente de H es considerado un enlace débil, es así si se lo considera de forma individual, pero a la abundancia de ellos crea una fuerza de gran importancia.
Espacialmente la proteína esta relacionada con la secuencia repetitiva de enlaces C-N-C-C-N-C formando la "columna vertebral" de la proteína. Estas estructuras están divididas en dos grandes tipos muy regulares la hélice alfa y la lamina beta y otro grupo no tan regular llamado Al azar (Random Coil).
*Hélice alfa: esta estructura es muy regular y extendida, tan regular que no admite en su composición iminoácidos ya que su anillo pirrolidina incluye el C-alfa y por ello no puede rotar forzando una posición fija en la cadena que le provoca torsiones, tampoco admite Aa muy reactivos (ácidos y básicos) vecinos entre sí ya que la interacción de ambos produciria pliegues y deformaciones en la hélice.
La hélice alfa es dextrogira, ya que se enrolla en sentido de las agujas del reloj. Esta hélice predomina en ciertas proteínas fibrosas como las queratinas de los pelos y las uñas.
* Lamina Beta: Esta es tan regular como la hélice alfa y a su vez más extendida ya que los Aa se encuentran más separados. Las laminas betas pueden unirse mediante puentes de H intermoleculares formando estructuras laminares que se plieguen en zig-zag o se doblan entre si mismas, formando una horquilla, y constituyen la lamina plegada. Esta lamina también predomina en ciertas proteínas fibrosas como la fobroína.
* Al azar (Random Coil): esta estructura no es muy regular como las anteriores, pero esto no quiere decir que adopte cualquier orientación sino que adopta aquella que sea más estable del punto de vista termodinámico. Estos segmentos predominan en ciertas proteínas globulares como las albuminas.
Estructura terciaria:
Esta estructura es tridimensional mantenida por varios tipos de fuerzas.
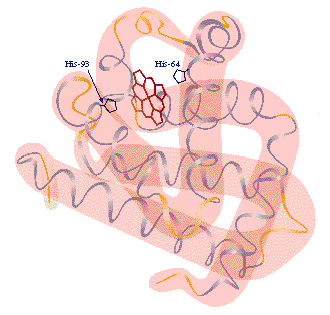
* Puentes de H: a diferencia de los de la estructura secundaria estos puentes de H se establecen entre las cadenas R de los Aa hidroxilados (tirosina, serina, treonina) en los cuales el H de su OH es atraido por el O del COOH de la cadena R de un Aa ácido (glutamico o aspartico) o por el N del grupo imidazol de la histidina.
* Enlaces electrocovalentes o iónicos: son atracciones electrostáticas, se lo llama también puente salino ya que se establece entre grupos cargados de signos opuestos (un ácido con una base, que forman una sal). En cambio si los grupos de igual signo darán fuerzas de repulsión electroestaticas.
* Puente disulfuro (S-S): se establece entre las cadenas laterales de dos cisteinas formando el Aa cistina. Este enlace es un enlace covalente muy fuerte dando propiedades de resistencia y viscosidad a ciertas proteínas fibrosas como la queratina.
* Fuerzas de Van der Walls: esta establecida entre cadenas laterales no cargadas (anillos aromaticos y cadenas alifaticas) que generan fuerza de repulsión de grupos hidrófobos en el agua y de atracción de grupos hidrofilos en la misma, así la cadena R de Aa no polares se disponen hacia el interior de la molécula mientras que los grupos polares carboxilos, sulfhidrilos, oxhidrilos y aminas de las cadenas R se disponen hacia el exterior contactando con el agua. Este tipo de fuerza es la más débil de las cuatro, pero aún así es la más importante en una proteína globular ya que en ella se puede establecer un enorme número de estos enlaces.
La estructura terciaria se encuentra dividida en 2 estructuras:
*Globular: esta permite acodaduras y plegamientos para que la molécula adopte una estructura esférica. Es hidrosoluble ya que en su configuración externa se encuentran los Aa polares. Presentan predomino de segmentos al azar que pueden constituir enteramente la proteína o bien pueden intercalarse con algunas hélice alfa y laminas beta, exceptuando la Hemoglobina que a pesar de ser globular presenta predominio de hélice alfa. Este tipo de proteínas pueden funcionar como hormonas, enzimas, anticuerpos etc.
*Fibrilar: Es insoluble en agua ya que presenta en su exterior los grupos no polares o hidrófobos. Presenta predominio de hélices alfas o laminas beta. Son proteínas de sostén en las que predomina un eje longitudinal.
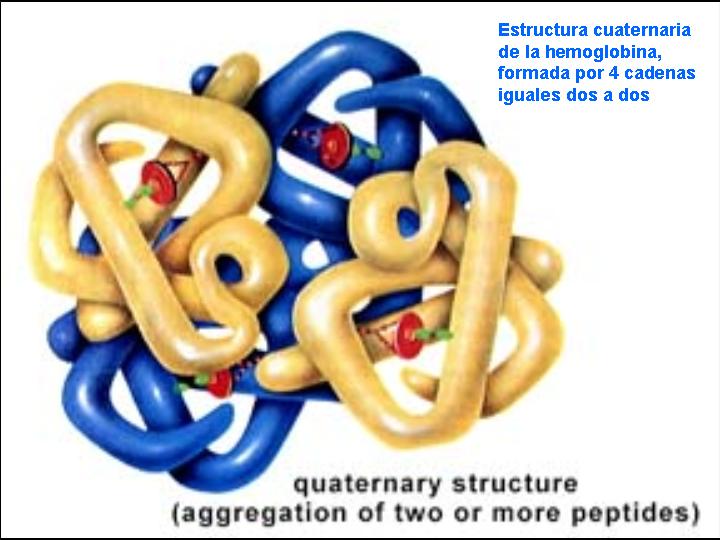
Estructura cuaternaria:
Se forma por la unión de muchas proteínas mantenidas por los mismos enlaces que mantienen la terciaria, cuando una proteína llega a nivel cuatro se dice que es oligomérica. Por su parte cada una de las unidades que conforman a una proteína oligomérica se llaman protómero.
Desnaturalización e Hidrólisis
La desnaturalización es la ruptura de las estructuras cuaternarias y terciarias, y a veces también de la secundaria, de una proteína sin afectar a la estructura primaria. Este proceso puede ser reversible o irreversible generalmente lleva a la perdida de su función biológica.
Esto puede ocurrir por la acción de:
-calor
-radiaciones
-metales pesados
-ácidos o bases fuertes
-congelamientos repetidos
-grandes presiones
-alcoholes y otros solventes orgánicos
La Hidrólisis es la degradación completa de una proteína, es irreversible ya que produce la separación de los Aa constituyentes, destruyendo los enlaces peptídicos y no permite conocer la estructura primaria de la proteína. Esta puede ocurrir de dos maneras:
Por hidrólisis ácida ocasionada por ácidos fuertes a altas temperaturas y presión.Y la hidrólisis enzimática, ocasionada por enzimas proteolícas, las cuales pueden ser Exopeptidasa que atacan las uniones peptídicas desde los extremos del peptido, por lo cual se divide en Carboxipeptidasa que ataca desde el extremo C-terminal y la Aminopeptidasa, que ataca las uniones peptidicas desde el extremo N -terminal. Y Endopeptidasa que atacan las uniones peptidicas del interior de la molécula, esta a su vez se divide en pepsina, tripsina y quimotripsina.
¿Son solubles las proteínas?
La mayoría de las proteínas son hidrosolubles ya que presentan los Aa polares o hidrófilos hacia el exterior. Estas disueltas en H2O (agua) forman soluciones coloidales de la cual su estabilidad depende de:
La capa de Solvatación, que es una capa de H2O ligada a las proteínas a las que le bloquea sus grupos reactivos de forma tal que esta no puede interaccionar entre sí. este bloqueo se da porque el H2O presenta una elevada constante dieléctrica aislando entre si a grupos de cargas opuestas en diferentes moléculas.
Las cargas de la proteína, es la separación de las proteínas por poseer cargas iguales, ya que las proteínas extracelulares presentan un pI menor a 7, que al pH fisiológico que es 7.4 tienen carácter ácido, es decir tienen cargas negativas.
¿Como se clasifican las proteínas?
Las proteínas se pueden clasificar de acuerdo a su asociación o no con otras estructuras no proteicas, en Simples y Conjugadas.
Las proteínas Simples se clasifican en Fibrosas y Globulares.
De las Fibrosas hay tres clases principales que son la queratina, la elastina y el colágeno. También se las llama proteínas albuminoides o escleroproteínas ya que por su resistencia forman los tejidos de sostén del organismo.
La Queratina es una proteína insoluble de las que hay dos tipos: alfa y beta
*Alfa-queratinas: Son muy ricas en Aa cistina, por lo que se establecen numerosos puentes disulfuro que la hacen muy resistente. Una de las características de las alfa queratinas es que se estiran en presencia de calor y se contraen por enfriamiento.
*Beta-queratinas: Son ricas en Aa con cadenas laterales cortas, como glicina, alanina y serina. Estructuralmente predominan en ella las láminas beta, plegadas y en zig zag. Como no tiene cistinas no hay puentes de S-S, pero se compensa con una gran cantidad de puentes de H.
El Colágeno es la proteína más frecuente en los vertebrados. Es insoluble en H2O y difícil de digerir por las enzimas gastrointestinales. Se encuentra en la piel, los huesos, los tendones y los cartílagos.
Su estructura primaria es muy rica en glicina, prolina, Aa hidroxilados (hidroxiprolina e hidroxilisina) y alanina. La secuencia más frecuente que presenta es glicil-prolil-hidroxiprolil. cosa que es muy infrecuente en otro tipo de proteínas.
Al presentar prolina en su cadena, hace imposible que en su estructura secundaria forme la hélice alfa, por lo que forma hélices más extendidas con 3 Aa por vuelta y enrollada hacia la izquierda, esto se denomina hélice del colágeno, ya que solo en esta proteína esta presente.
En la estructura terciaria, tres de estas hélices del colágeno se asocian para formar una superhélice conectadas por puentes de H. Esta estructura es extendida de tipo fibrilar. La triple hélice del colágeno forma una unidad estructural llamada tropo-colágeno que se empaquetan en haces que constituyen fibrillas. Los tropocolágenos de fibrillas paralelas adyacentes se unen entre sí mediante enlaces cruzados entre lisinas, lo que forma un Aa derivado llamado lisinorleusina, que le da su gran resistencia a la tracción. Con la edad el colágeno se hace más rígido y frágil.
Existen cuatro tipo de colágenos:
* Tipo I: presente en los tejidos conectivos densos (ver tejido conectivo) hueso, córnea y dientes.
* Tipo II: presente en el cartílago.
* Tipo III: presente en el tejido conectivo laxo de la piel (ver tejido conectivo y piel)y otros órganos.
* Tipo IV: presente en las membranas basales.
La Elastina es la proteína que esta presente en las fibras elásticas, la cual esta constituida por la tropoelastina. Al igual que el colágeno es rica en glicina y alanina pero difiere en que contiene mucha lisina y poca prolina. Así como el colágeno, la elastina forma una hélice especial, 4 lisinas adyacentes son convertidas enzimáticamente en desmosina e isodesmosina, Aa derivados típicos de la elastina. Estos pueden unir las cadenas de la elastina y formar una malla elástica que se estira en todas direcciones.
Por su parte las proteínas Globulares presentan cuatro tipos, las Albúminas, las Globulinas, las Histonas, las Glutelinas y Gliadinas.
Las Albúminas son proteínas solubles en agua, presenten carácter ácido pI 4,7. Esta posee muchos grupos reactivos por lo que puede unirse a otras moléculas, lo que la convierte en un excelente transportador de sustancias en el plasma. Esta proteína se encuentra en tejidos animales y vegetales .
Las Globulinas son insolubles en agua pero se disuelven en soluciones salinas diluidas, se las encuentra en el plasma donde cumplen varias funciones como los anticuerpos, el transporte, etc. Esta esta dividida en alfa-1 (antitripsina, protrombina) , alfa-2 (ceruloplasmina, eritopoyetina), beta (transferrina o siderofilina) y gama (inmuno globulinas)
Las Histonas son proteínas básicas pI mayor a 7 por esto se unen a sustancias ácidas como el ADN formando proteínas conjugadas llamadas nucleoproteínas, poseen muchas lisinas, argininas e histidinas.
Las Glutelinas y Gliadinas estas se encuentran en los cereales donde presentan valor nutritivo por presentar un elevado porcentaje de Aa esenciales.
Las proteínas Conjugadas están formadas por una proteína simple llamada apoproteína unida a otra no proteica llamada grupo prostético, estas se clasifican en:
*Nucleoproteínas: formadas por ácidos nucleicos más proteínas básicas como las histonas o protaminas, formando cromosomas (proteínas unidas a ADN) y ribosomas (proteínas unidas a ARN).
* Cromoproteína formada por proteínas unidas a un grupo prostético coloreado como el hemo, que forma la hemoglobina, la mioglobina y los citocromos.
* Glicoproteína su grupo protético lo constituyen glúcidos o derivados de ellos como el ácido neuramínico. Cuando está constituido por heteropolisacaridos de gran peso molecular se los llama mucoproteínas.
* Fosfoproteínas su grupo prostético es el ácido fosfórico.
* Lipoproteína su grupo prostético son lípidos. Se las encuentran en el plasma.
* Metaloproteínas son proteínas unidas a metales como Cu, Zn, Mg, Mn y Fe. A estas últimas se las llama ferroproteínas.
Su estructura primaria es muy rica en glicina, prolina, Aa hidroxilados (hidroxiprolina e hidroxilisina) y alanina. La secuencia más frecuente que presenta es glicil-prolil-hidroxiprolil. cosa que es muy infrecuente en otro tipo de proteínas.
Al presentar prolina en su cadena, hace imposible que en su estructura secundaria forme la hélice alfa, por lo que forma hélices más extendidas con 3 Aa por vuelta y enrollada hacia la izquierda, esto se denomina hélice del colágeno, ya que solo en esta proteína esta presente.
En la estructura terciaria, tres de estas hélices del colágeno se asocian para formar una superhélice conectadas por puentes de H. Esta estructura es extendida de tipo fibrilar. La triple hélice del colágeno forma una unidad estructural llamada tropo-colágeno que se empaquetan en haces que constituyen fibrillas. Los tropocolágenos de fibrillas paralelas adyacentes se unen entre sí mediante enlaces cruzados entre lisinas, lo que forma un Aa derivado llamado lisinorleusina, que le da su gran resistencia a la tracción. Con la edad el colágeno se hace más rígido y frágil.
Existen cuatro tipo de colágenos:
* Tipo I: presente en los tejidos conectivos densos (ver tejido conectivo) hueso, córnea y dientes.
* Tipo II: presente en el cartílago.
* Tipo III: presente en el tejido conectivo laxo de la piel (ver tejido conectivo y piel)y otros órganos.
* Tipo IV: presente en las membranas basales.
La Elastina es la proteína que esta presente en las fibras elásticas, la cual esta constituida por la tropoelastina. Al igual que el colágeno es rica en glicina y alanina pero difiere en que contiene mucha lisina y poca prolina. Así como el colágeno, la elastina forma una hélice especial, 4 lisinas adyacentes son convertidas enzimáticamente en desmosina e isodesmosina, Aa derivados típicos de la elastina. Estos pueden unir las cadenas de la elastina y formar una malla elástica que se estira en todas direcciones.
Por su parte las proteínas Globulares presentan cuatro tipos, las Albúminas, las Globulinas, las Histonas, las Glutelinas y Gliadinas.
Las Albúminas son proteínas solubles en agua, presenten carácter ácido pI 4,7. Esta posee muchos grupos reactivos por lo que puede unirse a otras moléculas, lo que la convierte en un excelente transportador de sustancias en el plasma. Esta proteína se encuentra en tejidos animales y vegetales .
Las Globulinas son insolubles en agua pero se disuelven en soluciones salinas diluidas, se las encuentra en el plasma donde cumplen varias funciones como los anticuerpos, el transporte, etc. Esta esta dividida en alfa-1 (antitripsina, protrombina) , alfa-2 (ceruloplasmina, eritopoyetina), beta (transferrina o siderofilina) y gama (inmuno globulinas)
Las Histonas son proteínas básicas pI mayor a 7 por esto se unen a sustancias ácidas como el ADN formando proteínas conjugadas llamadas nucleoproteínas, poseen muchas lisinas, argininas e histidinas.
Las Glutelinas y Gliadinas estas se encuentran en los cereales donde presentan valor nutritivo por presentar un elevado porcentaje de Aa esenciales.
Las proteínas Conjugadas están formadas por una proteína simple llamada apoproteína unida a otra no proteica llamada grupo prostético, estas se clasifican en:
*Nucleoproteínas: formadas por ácidos nucleicos más proteínas básicas como las histonas o protaminas, formando cromosomas (proteínas unidas a ADN) y ribosomas (proteínas unidas a ARN).
* Cromoproteína formada por proteínas unidas a un grupo prostético coloreado como el hemo, que forma la hemoglobina, la mioglobina y los citocromos.
* Glicoproteína su grupo protético lo constituyen glúcidos o derivados de ellos como el ácido neuramínico. Cuando está constituido por heteropolisacaridos de gran peso molecular se los llama mucoproteínas.
* Fosfoproteínas su grupo prostético es el ácido fosfórico.
* Lipoproteína su grupo prostético son lípidos. Se las encuentran en el plasma.
* Metaloproteínas son proteínas unidas a metales como Cu, Zn, Mg, Mn y Fe. A estas últimas se las llama ferroproteínas.



No hay comentarios:
Publicar un comentario